基因编辑技术的迅速发展为解析复杂发育过程中的基因功能提供了重要工具。然而,相关技术在斑马鱼中的应用仍存在一些局限性:例如CRISPR/Cas9介导的全胚基因敲除往往导致胚胎早期死亡,而Cre/loxP条件性敲除系统则受限于loxP序列的种系敲入效率率及位点的限制等因素的影响。上述问题在一定程度上阻碍了针对斑马鱼时空特异性发育调节机制的深入研究。
2026年1月2日,清华大学生命科学学院孟安明课题组在《细胞生物学期刊》(Journal of Cell Biology)发表题为“通过4-OHT诱导型Cas9在整胚中实现时期及组织特异性基因编辑”(Stage- and tissue-specific gene editing using 4-OHT-inducible Cas9 in whole organism)的研究论文。该研究在斑马鱼中建立了一套生殖细胞系特异、可诱导的基因编辑系统,并证明通过4-OHT处理,可在不同发育阶段特异敲除生殖细胞系中的靶基因,实现时间特异性及组织特异性双重调控。此外,该诱导型Cas9蛋白在小鼠早期胚胎中同样可以实现条件性基因敲除,为跨物种研究提供了潜在工具。

研究团队基于4-羟基他莫昔芬(4-hydroxytamoxifen,4-OHT)与突变型雌激素受体(estrogen receptor, ER)构建了4-OHT诱导型Cas9蛋白nCas9ERT2,并在HEK293T细胞系中验证其在4-OHT处理后可诱导nCas9ERT2蛋白入核进行基因编辑。随后,研究人员构建了生殖细胞系特异表达诱导型Cas9蛋白转基因斑马鱼品系Tg(piwil1:nCas9ERT2-n3U)和泛表达gRNA转基因斑马鱼品系Tg(U6:gRNAs,cryaa:CFP)。实验结果表明,该诱导型nCas9ERT2蛋白在斑马鱼胚胎原始生殖细胞(PGCs)及雌鱼卵母细胞中均成功响应4-OHT诱导,实现时期及组织特异性基因编辑。与传统的组织特异性基因编辑系统相比,该系统通过控制基因编辑的时间,有效避免了早期胚胎体细胞脱靶编辑,凸显该技术在胚胎早期PGCs研究中的重要价值。利用该系统,研究人员进一步探究了tbx16基因在PGC迁移过程中的功能,发现PGC特异敲除tbx16基因会影响PGC迁移,为理解tbx16在斑马鱼胚胎发育中的功能提供了新的实验证据,并拓展了对其参与斑马鱼PGC发育过程调控的认知。
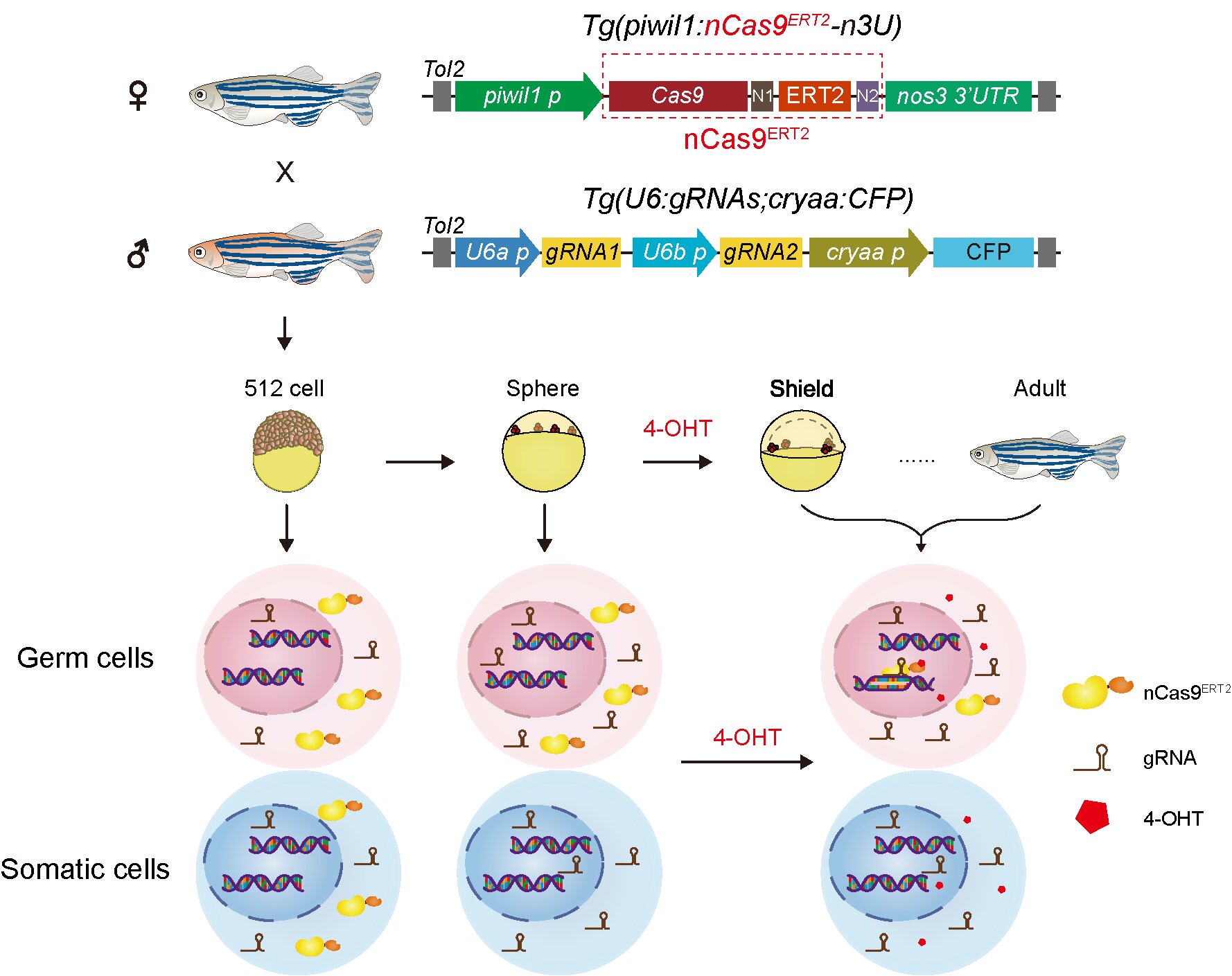
图:该时空特异性基因编辑系统及转基因斑马鱼品系模式图
清华大学生命科学学院吴小童副研究员及孟安明院士为本文通讯作者;2024届博士毕业生李雅琪、2025届博士毕业生张渭莹、危子航为本文的共同第一作者;2019级博士研究生李晗、2022级博士研究生图尔荪江·艾则孜、博士后刘鑫与郑涛等在该研究做出重要贡献;北京科技大学幸岑璨副教授参与了课题指导。本研究得到国家自然科学基金、国家重点研发计划、清华-北大生命科学联合中心、膜国家重点实验室的资助。
论文链接:https://doi.org/10.1083/jcb.202412216