受体酪氨酸激酶(RTK)是细胞膜上调控细胞生长、存活及增殖的一类重要的膜受体蛋白,其异常激活与肿瘤等重大疾病的发生发展密切相关。传统理论认为,配体诱导的受体多聚化(二聚化/寡聚化)是RTK激活的经典模式。然而近年研究提示,相分离亦可能参与RTK信号调控,但从生物分子组织的角度看,多聚化与相分离在RTK信号激活中的功能差异及机制,是领域内亟待阐明的核心科学问题。
2025年12月1日,清华大学生命科学学院、膜生物学全国重点实验室、北京生物结构前沿研究中心、清华—北大生命科学联合中心李丕龙团队在《细胞化学生物学》(Cell Chemical Biology)杂志在线发表题为“生物分子组织的光遗传学调控揭示相分离在受体酪氨酸激酶信号中的独特作用”(Optogenetic control of biomolecular organization reveals distinct roles of phase separation in RTK signaling)的研究论文。该研究利用两类蓝光敏感蛋白的协同作用,创新性开发出光控相分离系统CORdensate,并通过体系改造实现了生物分子“单体-低阶多聚体-高阶多聚体-相分离”四种组织模式的精准调控。以ALK、RET两种典型RTK为研究对象,团队证实:相分离的生物分子组织活性显著优于多聚化。该研究不仅为生物分子相分离功能研究提供了新型光遗传学工具,更为解析相分离调控RTK信号的机制提供了关键实验证据,为靶向RTK异常相分离的疾病治疗奠定理论基础。
明确生物分子相分离与功能之间的因果关系,是相分离研究领域的核心需求;光遗传学工具的高时空分辨率特性为该问题提供了技术支撑,但现有光控相分离工具普遍存在正交性不足、动力学调控灵活性差、难以区分不同分子组织模式功能差异等局限。
针对上述瓶颈,李丕龙团队基于“多价互作驱动相分离”的基本原理,创新性整合两类协同作用的光激活元件:拟南芥来源的蓝光激活的同源四聚体Cry2,以及工程改造的蓝光诱导异源二聚体LOVpep/ePDZ,构建了CORdensate系统(图1)。通过抑制剂(如Cry2抑制蛋白BIC1)干预与突变体(如Cry2(D387A)、LOVpep突变体LOVmut)验证,研究证实:CORdensate的相分离严格依赖Cry2的寡聚化活性及LOVpep与ePDZ的特异性互作,二者缺一不可。
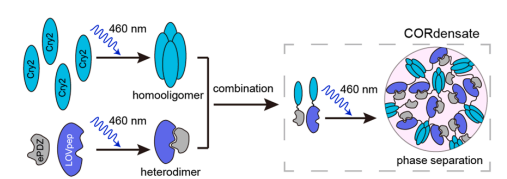
图1 CORdensate光控相分离系统的工作原理
为进一步拓展工具应用场景,团队对CORdensate进行改造,将二元蛋白驱动体系优化为单链多肽驱动的相分离系统(ps-CORd);随后通过引入非活化型突变体Cry2(D387A)与LOVmut,成功构建另外3种单链光控开关(oH-CORd:高阶多聚体型、oL-CORd:低阶多聚体型、m-CORd:单体型)。这4种光控开关可实现生物分子四种组织模式的精准调控,为解析不同组织模式的功能差异提供了重要研究工具。
为明确CORdensate的技术特性,团队将其与经典光控相分离系统optoDroplet(以optoFUS、optoTDP43和optoDDX4为例)进行系统性比较。结果显示:optoDroplet的相分离行为高度依赖所融合的固有无序区(IDR)蛋白特性 —— 例如optoFUS相较于optoTDP43、optoDDX4更易形成不可逆纤维状聚集体,该异质性可能源于不同IDR与细胞内源性生物分子的互作网络差异。与之相比,CORdensate展现出显著更优的动力学特性:组装过程温和,解聚速率更快,且组装 - 解聚动力学稳定;即使在强光激活条件下,也不易形成凝胶样不可逆聚集体,有效规避了传统工具的稳定性缺陷(图2)。
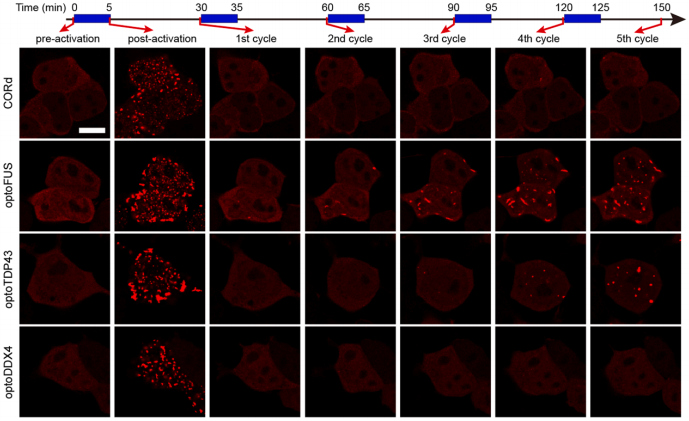
图2 CORdensate和optoDroplet具有不同的光控相分离动力学行为
为验证相分离对RTK信号的调控作用,团队首先模拟疾病相关的RTK异常相分离场景 —— 以ALK、RET为模型,证实CORdensate介导的相分离可有效激活RTK,招募GRB2、SOS1等下游信号蛋白,激活RAS-MAPK、JAK-STAT3等信号通路(图3)。
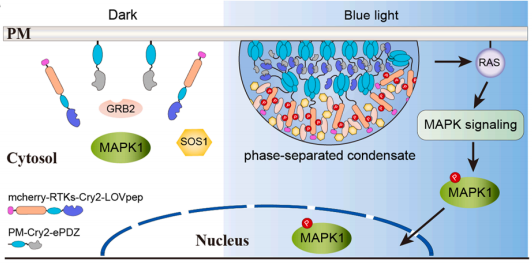
图3 CORdensate介导的光控相分离激活RTK
进一步,为精准区分多聚化与相分离的功能差异,团队利用4种单链光控开关,定量比较了不同生物分子组织模式对RTK激活的作用:结果表明,多聚化虽能激活RTK信号,但相分离可显著提升激活效率,展现出更强的生物分子组织能力(图4)。为确认该机制的普适性,团队将研究拓展至另外24种RTK(涵盖EGFR、FGFR4、LTK等),发现其中12种RTK均可通过CORdensate介导的相分离实现信号激活,表明相分离在RTK信号调控中的广谱性作用。
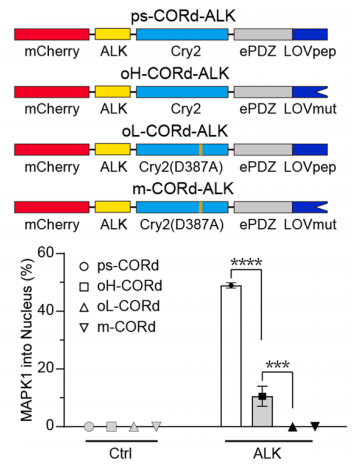
图4 相分离比多聚化能更有效激活RTK
综上所述,该研究构建了一个新的光控相分离系统CORdensate,可用于解析生物分子的相分离与其功能之间的因果关系。基于CORdensate的研究揭示了相分离在调控RTK信号中的重要作用,相分离比多聚化具有更高生物分子组织效率。
清华大学生命科学学院、膜生物学全国重点实验室、北京生物结构前沿研究中心、清华—北大生命科学联合中心李丕龙副教授为本文通讯作者;已出站博士后周敏、2022级博士生石宁为共同第一作者。本研究得到国家自然科学基金、国家重点研发计划的资助。
原文链接:https://doi.org/10.1016/j.chembiol.2025.11.001