在动物早期胚胎发育中,受精后的父母源基因组会经历一次大规模的三维染色质结构重塑。基因组常见的结构如拓扑相关结构域(topologically associating domains, TADs)和区室(compartments)几乎存在于所有细胞中。但在受精后,TADs和compartments迅速解体,同时染色质呈现出一种高度松弛的状态。这种结构的“擦除”被认为有助于重置基因调控网络,为胚胎发育启动提供新的起点。该过程在目前所有已研究的动物早期胚胎(包括果蝇、爪蟾、斑马鱼、青鳉鱼、小鼠、猪以及人类)中均高度保守。另一方面,染色质高级结构的逐步重建同时伴随着合子基因组激活(zygotic genome activation, ZGA)的发生。然而,在哺乳动物中这一过程中染色质结构是如何被建立,以及其与生命的第一次基因表达之间的关系仍然知之甚少。
2025年8月13日,清华大学生命科学学院颉伟课题组在《自然》(Nature)杂志上发表研究论文“早期胚胎中染色质高级结构重建与胚胎超转录间的相互作用”(Establishment of chromatin architecture interplays with embryo hypertranscription),系统研究了小鼠早期胚胎中染色质高级结构逐步建立过程的调控机制,并揭示了其与一种特殊“超转录”状态之间的双向作用,超活跃的转录活动与染色质高级结构相互促进,共同推动胚胎发育基因程序。
研究首先发现,调控染色质高级结构的关键因子CTCF在整个小鼠早期发育过程中始终稳定结合于基因组。进一步研究发现,除了大多数保守的CTCF结合位点外,CTCF还结合于两类可变区域:一类在1–2细胞期结合较弱,8细胞时期后显著增强,主要分布在启动子区域,且与部分ZGA基因相关;另一类则在1–8细胞期结合较强,但在囊胚内细胞团(inner cell mass,ICM)及后续阶段迅速消失,这类位点多位于SINE B2重复元件上。B2位点上的CTCF结合减少与转录因子ADNP在同一时期的高表达密切相关。ADNP能够与CTCF竞争结合这些B2位点。在ADNP缺失的胚胎中,B2位点的CTCF结合和染色质绝缘性都得以恢复,这些结果揭示了早期胚胎中特定重复序列上CTCF结合及其对染色质高级结构动态调控的机制,与去年高亚威/张勇/高绍荣课题组研究结果一致1。
相比CTCF的稳定结合模式,另一种关键结构蛋白——黏连蛋白复合物(cohesin)在1细胞期结合水平极低。这与早期胚胎中cohesin组份及其装载因子NIPBL的低表达,以及卸载因子WAPL的高表达一致。较低的装载效率和较高的卸载效率使得cohesin的环挤压过程的持续性不足。随着发育从2细胞期到8细胞期推进,cohesin及NIPBL的表达增强,WAPL表达下调,cohesin的环挤压能力逐步增强,TAD结构随之逐渐恢复。
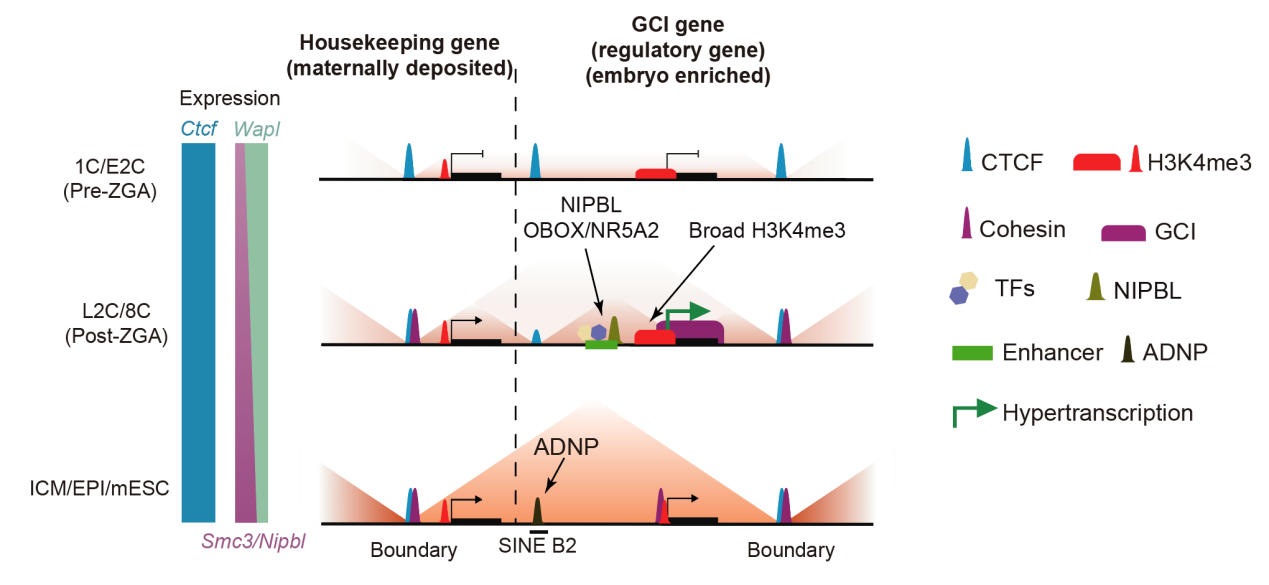
图1:小鼠早期胚胎中染色质高级结构的重建与超转录状态间的相互作用
有趣的是,研究团队在2–8细胞期胚胎中的活跃基因上发现了特殊的cohesin富集现象,通常覆盖于整个基因体区域。作者将其定义为genic cohesin islands(GCIs)。GCIs是早期胚胎特有的,在ICM和后续阶段的胚胎中迅速消失。进一步研究表明,GCIs与RNA聚合酶II(Pol II)高度共定位。短暂抑制转录延伸会导致GCIs迅速消失,而诱导转录则可在胚胎中产生新的GCIs,表明GCIs的形成依赖于活跃转录。为了探究为何GCIs仅在早期短暂出现,研究人员对Pol II的结合模式和转录活性进行了定量分析,发现2–8细胞期胚胎处于一种显著的“超转录”(hypertranscription)状态,其新激活基因的转录强度比胚胎干细胞分化阶段高6–10倍,比原肠胚形成阶段高2–3倍。这种超转录状态可能是产生早期胚胎特异的GCIs的必要条件之一。
随后的功能分析显示,GCI相关基因更加富集于与染色质结构组织、发育调控及细胞命运决定等关键调控类基因类别。这些基因邻近区域富集活跃增强子和胚胎特异转录因子的结合如OBOX, NR5A2, TFAP2C,以及有着更多cohesin装载因子NIPBL的结合,这可能为GCIs的形成提供了大量的cohesin装载位点。已有研究表明,RNA聚合酶可作为障碍(barrier)阻止cohesin在染色质上的滑动,进而影响染色质高级结构2-4。进一步的Hi-C分析发现,GCIs可以作为转录依赖的绝缘元件,与邻近的CTCF位点协同形成类似TAD的相互作用域,且无明显方向偏好性。反过来,cohesin的部分敲降削弱了GCIs的绝缘效应,同时降低了GCI基因表达,最终胚胎停滞于桑椹胚(morula)阶段。最后,研究者发现GCI基因具有较低的表达噪音,而这种表达的稳定性依赖于cohesin,提示GCIs保障快速发育的胚胎中关键调控基因的稳定高水平表达。
综上,该研究揭示了小鼠早期胚胎中染色质高级结构重建与超转录状态间的相互作用:在ZGA之后,胚胎迅速激活特定调控基因,高密度的RNA聚合酶II在基因内部阻滞cohesin的滑动,从而形成GCIs。GCIs反过来与CTCF协同建立高级染色质结构,进而促进胚胎高效而稳定的转录。这些研究提示,GCIs可能是在TAD尚未完全建立时承担胚胎关键基因特异高效表达的功能。此项工作为理解转录与三维基因组结构之间的耦合关系也提供了新的思路。
清华大学生命科学学院颉伟教授为本文通讯作者,清华大学生命科学学院博士后于广、博士后许锴(已出站)、博士后夏炜焜(已出站)、2016级博士生张珂(已毕业)为论文共同第一作者。清华大学生命科学学院副研究员徐倩华、博士后李丽佳(已出站)、北京农学院动物科学技术学院副教授林自力、颉伟实验室助理刘玲、清华大学生命科学学院博士后刘伯峰和杜振海(已出站)也在该课题中作出了重要贡献。江苏省农业科学院畜牧研究所王慧利研究员、中国科学院分子细胞科学卓越创新中心代海强研究员及其实验室博士后王超、西湖大学于洪涛教授和史竹兵研究员为本课题提供了实验指导和重要实验材料。该课题得到了清华大学实验动物中心的大力协助和支持。研究得到国家自然科学基金会、国家科技部重点研发计划、清华-北大生命科学联合中心和中国博士后科学基金的经费支持。颉伟教授是HHMI国际研究学者和新基石研究员。
参考文献:
1. Wang, W., Gao, R., Yang, D., Ma, M., Zang, R., Wang, X., ... & Gao, Y. (2024). ADNP modulates SINE B2-derived CTCF-binding sites during blastocyst formation in mice. Genes & Development, 38(3-4), 168-188.
2. Busslinger, G. A., Stocsits, R. R., Van Der Lelij, P., Axelsson, E., Tedeschi, A., Galjart, N., & Peters, J. M. (2017). Cohesin is positioned in mammalian genomes by transcription, CTCF and Wapl. Nature, 544(7651), 503-507.
3. Banigan, E. J., Tang, W., van den Berg, A. A., Stocsits, R. R., Wutz, G., Brandão, H. B., ... & Mirny, L. A. (2023). Transcription shapes 3D chromatin organization by interacting with loop extrusion. Proceedings of the National Academy of Sciences, 120(11), e2210480120.
4. Heinz, S., Texari, L., Hayes, M. G., Urbanowski, M., Chang, M. W., Givarkes, N., ... & Benner, C. (2018). Transcription elongation can affect genome 3D structure. Cell, 174(6), 1522-1536.
原文链接:https://www.nature.com/articles/s41586-025-09400-5
颉伟实验室主页:www.xielab.org.cn