机体的胆固醇稳态由各种组织相互协调,以保持外源胆固醇吸收、内源胆固醇从头合成以及胆汁清除和外排之间的平衡。血液中胆固醇水平升高,尤其是低密度脂蛋白胆固醇(LDL-C)水平升高,是引发动脉粥样硬化等心脑血管疾病的重要风险因素。他汀类药物、PCSK9抑制剂等心脑血管疾病一线用药也主要通过降低LDL-C发挥功能1。外源胆固醇的吸收增加会抑制内源胆固醇的合成,而外源胆固醇摄入不足会激活内源胆固醇的合成。胆固醇自身作为信号分子通过抑制SCAP-SREBP复合体活性负反馈调节细胞的胆固醇合成2。小肠是外源胆固醇吸收的场所,肝脏是内源胆固醇合成的主要器官,肠道胆固醇吸收和肝脏胆固醇合成之间是否存在独立于胆固醇的调节通路尚不清楚。
2024年3月18日,清华大学生命科学学院王一国团队与南方医科大学南方医院张惠杰团队在《细胞》(Cell)杂志在线发表了题为“一种肠源激素对胆固醇代谢的调控”(A gut-derived hormone regulates cholesterol metabolism)的研究论文,首次发现并命名了一种肠道激素Cholesin(肠抑脂素),揭示了Cholesin调控机体胆固醇稳态的作用和机制。

为了确定参与介导肠道胆固醇吸收和肝脏胆固醇合成的调节因子,研究者对禁食过夜后喂食普通饮食(Regular Diet,RD)或含有高胆固醇西方饮食(Western Diet,WD)1小时的小鼠血浆蛋白进行富集和银染分析,发现喂食WD后在23kDa左右有明显增强条带。借助质谱技术确定该蛋白为未表征基因3110082I17Rik编码的蛋白,是人源C7orf50的同源蛋白。基于其对肝脏胆固醇合成的抑制作用,研究者将其命名为Cholesin(肠抑脂素)。通过分析Cholesin的组织分布,发现Cholesin在肠道中高表达,结合肠道是胆固醇吸收的主要器官,研究者推测Cholesin可能由肠道分泌,因此构建了肠道特异性敲除Cholesin的小鼠作为进一步研究的工具。后续结果表明肠道特异性敲除Cholesin的小鼠相比于野生型小鼠基本不再响应进食或胆固醇刺激下的Cholesin分泌,说明 Cholesin是一种响应胆固醇刺激的肠道激素。此外,研究者发现Cholesin主要在吸收性肠细胞表达,其分泌依赖于NPC1L1介导的胆固醇吸收。
为了探究Cholesin的功能,研究者通过分析GWAS数据找到了Cholesin中与人体血浆总胆固醇水平显著相关的SNP rs1007765。进一步对收集所得的600例人类临床样本进行检测,研究者发现血浆Cholesin水平与血浆总胆固醇水平和LDL-C水平呈较强负相关性,而携带rs1007765次要等位基因的人群血浆Cholesin水平显著上升,但血浆总胆固醇水平和LDL-C水平降低,验证了此前的GWAS分析结果。机制上,rs1007765定位于增强子区域,促进Cholesin的表达。
同时研究者利用肠道特异敲除Cholesin的小鼠探究了肠道分泌Cholesin在胆固醇稳态中的作用机制。肠道特异敲除Cholesin的小鼠在喂食普通饮食或西方饮食的雄性和雌性小鼠中,血浆总胆固醇水平都高于对照组小鼠,血浆脂蛋白各组分的胆固醇含量均有升高,该表型产生的原因是肝脏胆固醇合成和VLDL的分泌增加,说明Cholesin本身的作用是抑制肝脏胆固醇合成。研究者利用全基因组CRISPR/Cas9筛选鉴定了Cholesin的受体是GPR146。GPR146是A类GPCR孤儿受体。武汉大学王琰教授实验室与哈弗医学院Chad A. Cowan教授实验室前期研究发现肝脏GPR146是调节胆固醇代谢的关键受体,人群中GPR146的基因突变导致高胆固醇血症3,4。本研究中我们进一步发现Cholesin能够通过与GPR146结合抑制PKA信号,从而抑制肝脏中由SREBP2介导的胆固醇合成。
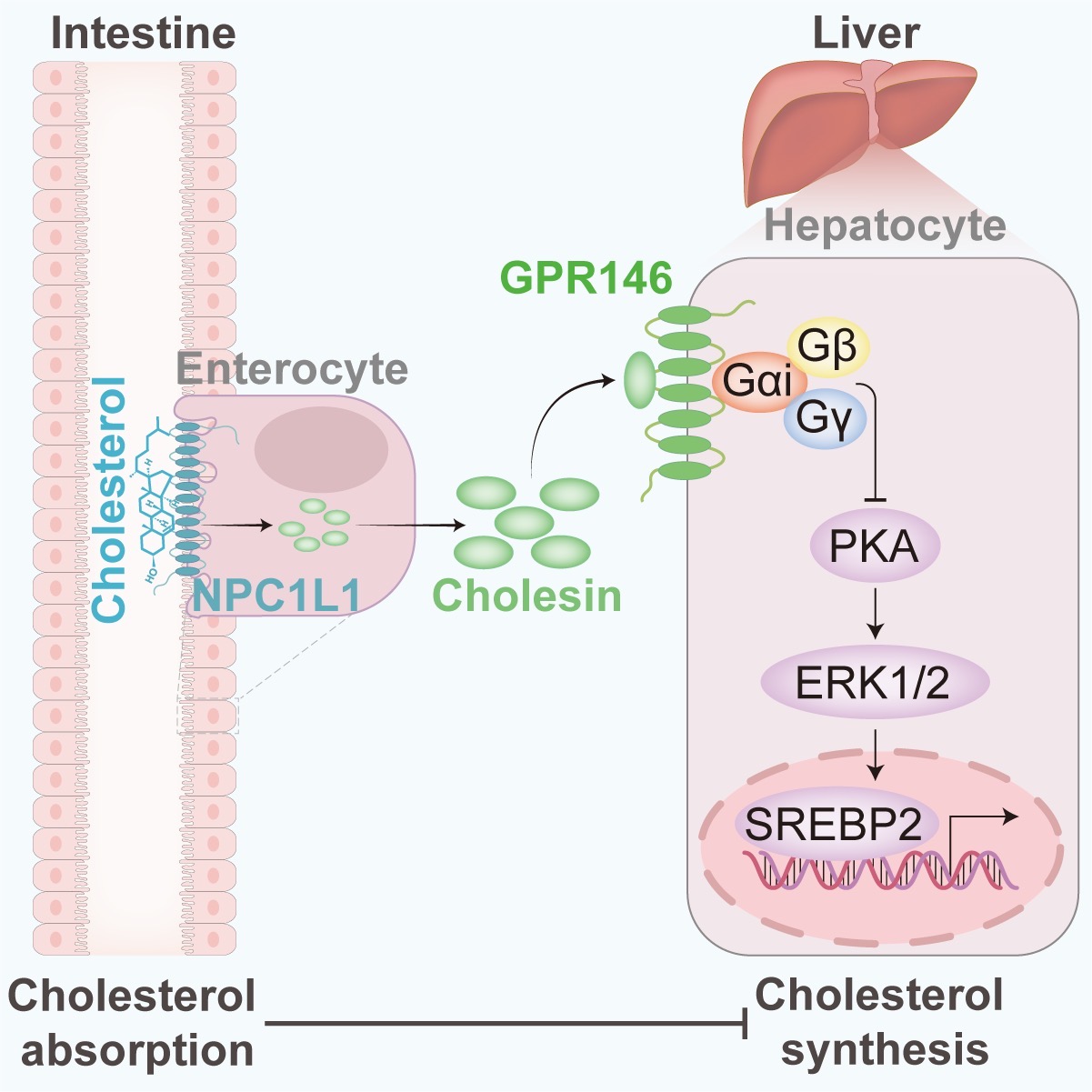
图:肠道来源的Cholesin抑制肝脏胆固醇合成
研究者发现外源注射Cholesin能抑制小鼠肝脏胆固醇的合成,对Ldlr基因敲除构建的高胆固醇血症与动脉粥样硬化的小鼠模型,外源注射Cholesin能降低小鼠血浆中的总胆固醇水平,并且对于动脉粥样硬化也有较好的治疗作用,而联合瑞舒伐他汀效果更佳。综上,该研究首次发现了肠道激素Cholesin,证明了Cholesin-GPR146 轴介导肠道胆固醇吸收对肝脏胆固醇合成的抑制作用,阐明了Cholesin在调控胆固醇稳态中的重要作用,为动脉粥样硬化等胆固醇代谢异常疾病提供了潜在靶点。
清华大学生命学院王一国副教授和南方医科大学南方医院张惠杰教授为本文的共同通讯作者,清华生命学院2018级博士生胡晓丽和2019级博士生陈丰艺为本文的共同第一作者。此外,王一国实验室已毕业的贾良杰博士、博士后隆艾君、博士后彭颖、2020级博士生房欣蕾和高梓华,南方医院张惠杰教授及团队2021级硕士生李旭、黄俊锋和魏雪云医师,清华大学陈晔光教授及团队2017级博士生张孟贤,武汉大学王琰教授及团队博士后刘笑也对本研究做出了重要贡献。感谢清华大学邓海腾教授,海军军医大学章卫平教授,武汉大学宋保亮教授教授,澳大利亚新南威尔士大学杨洪远教授和北京大学陈晓伟教授对该研究的建议和帮助。本研究获得了科技部、国家自然科学基金委和清华-北大生命科学联合中心的经费支持。