四氢叶酸 (Tetrahydrofolate, THF)及其衍生物,统称为叶酸,是体内一碳基团转移酶系的辅酶,可作为一碳基团的载体参与多种生物活性物质的合成,因而在几乎所有生命形式的正常细胞代谢中必不可少。在大多数植物、大部分真菌、细菌和古菌中,叶酸可经由相似的生物合成途径“从头 (de novo) 合成”。遗憾的是,人体并不能合成叶酸,必须完全依赖外源性供给。叶酸摄入缺乏可导致多种疾病,如贫血、胎儿畸形、心血管疾病、神经系统疾病等。因而,叶酸的生物合成与代谢途径已成为开发抗细菌和真菌药物的热门靶点。
在细菌中,与多种关键代谢途径相关基因的表达受到一大类被称为核糖开关(Riboswitch)的结构化RNA元件的调控。核糖开关是主要位于细菌mRNA 5’非翻译区的顺式作用RNA元件,其结构通常可分为适配体结构域及其下游的表达平台结构域。核糖开关发挥生理功能通常不依赖于蛋白因子,其适配体结构域可通过结合配体(如氨基酸/核苷酸及其衍生物、离子、tRNA等)或响应环境变化(温度,pH等)诱导表达平台结构域发生构象变化,进而在转录水平或翻译水平对下游基因的表达进行调控。目前鉴定发现的核糖开关已超过40种。其中,可识别THF及其类似物的核糖开关可分为两类(THF-I和THF-II)。THF-I于2010年被发现,主要存在于革兰氏阳性细菌,其晶体结构已于2011年被解析。THF-I含有4个双螺旋结构和两个THF结合位点(位点FA3WJ和FAPK),其中双螺旋P2, P3, P4形成倒置的“三支路”结构被一个长程假结(Pseudoknot)相互作用所稳定。通过解析晶体结构,人们揭示了THF-1识别配体和调控基因表达的分子机理。2019年,人们又于革兰氏阴性细菌中鉴定了一类全新的可识别THF及其类似物并在翻译水平调控基因表达的核糖开关,被命名为THF-II。与THF-I完全不同,THF-II具有更简单的结构,仅包含2个双螺旋结构,而且没有明显可区分的适配体结构域和表达平台结构域界限,在双螺旋结构P1的右臂则存在一个核糖体结合位点 (RBS)。然而,THF-II识别配体和调控基因表达的机制仍不清楚。
2023年1月9日,清华大学生命学院方显杨课题组在Nucleic Acids Research (核酸研究) 杂志在线发表了题为 “II型四氢叶酸核糖开关调控基因翻译的结构基础” (Structural insights into translation regulation by the THF-II riboswitch) 的研究论文,报道了第二类可特异性结合THF及其类似物的天然核糖开关THF-II的三维结构,揭示了其识别配体和调控基因翻译的结构机制。
研究者首先应用等温滴定量热法研究了镁离子对THF-II与配体(如THF)结合的重要影响,通过优化RNA序列进行了结晶筛选,应用X射线晶体学方法解析了THF-II与不同配体形成复合物及其C22G突变体的无配体结合状态下的高分辨率结构。晶体结构表明,THF-II的两个双螺旋P1,P2及其连接区通过共轴堆积形成长棒状结构,位于连接区的保守嘧啶(J12的C22,J21的U44)通过与四氢叶酸及其类似物的蝶呤环部分形成6对氢键相互作用进行识别,其识别模式与THF-I的FAPK类似(图1A)。接下来,研究者结合小角X射线散射(Small angle X-ray scattering),定点突变和寡核苷酸介导的核糖核酸酶H酶切实验(Oligonucleotide-directed RNase H cleavage assay),研究了镁离子和配体结合对THF-II的折叠,构象动态以及位于P1的RBS的可及性的影响(图1B)。基于相关实验结果,研究者提出了THF-II核糖开关调控基因翻译的模型(图1C):在没有镁离子时,RNA处于去折叠的状态,此时无法结合配体;镁离子的结合可极大促进RNA的折叠使其获得配体结合能力,但此时其共轴堆积的结构尚未形成,RBS暴露程度较高,核糖体可与之结合,介导下游基因翻译起始;当配体结合后,类似于晶体结构中THF-II的共轴堆积结构形成, RBS的暴露程度极大降低,核糖体无法与之结合,下游基因翻译停止。
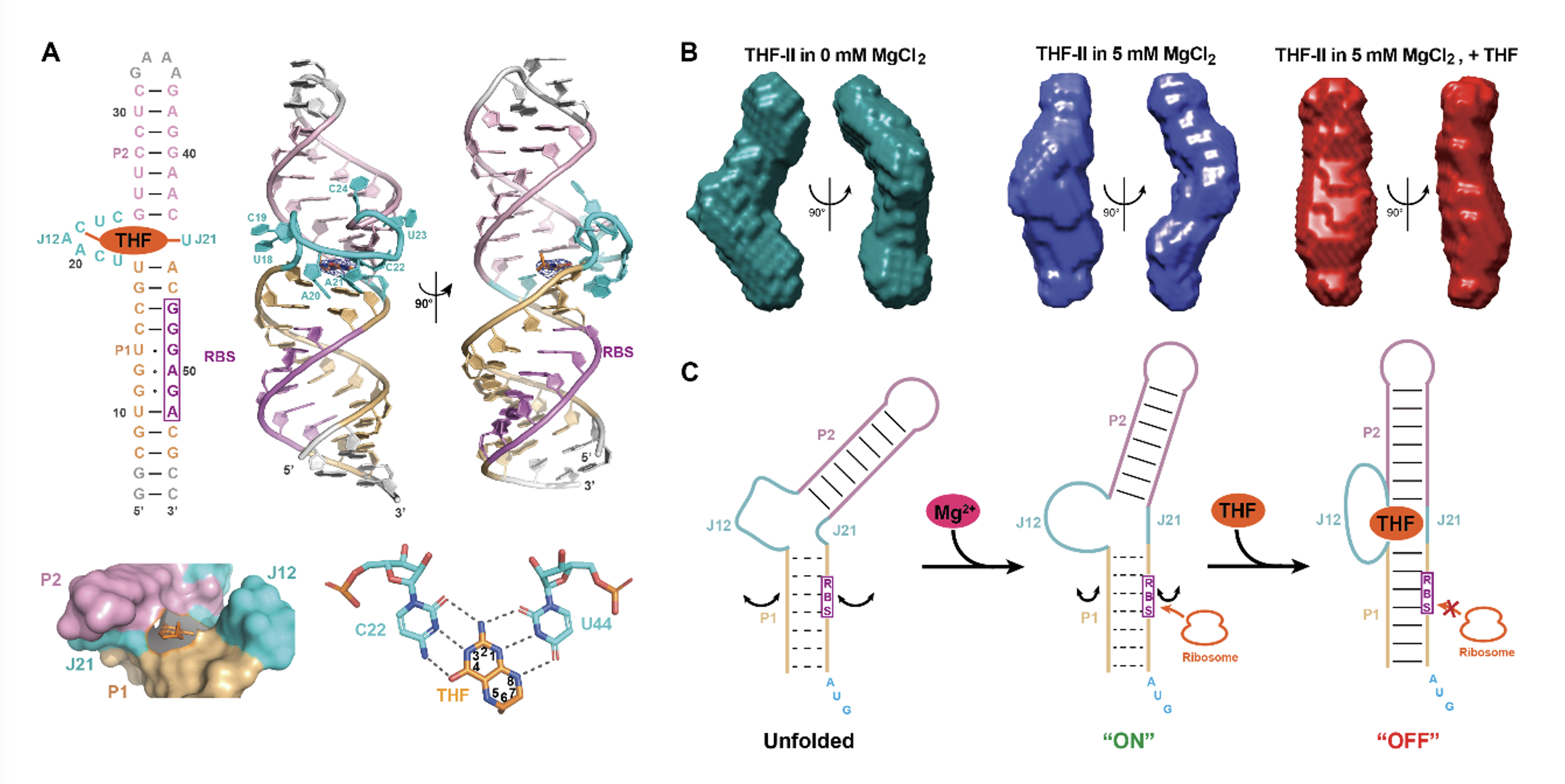
图1. THF-II核糖开关识别配体和调控基因翻译的机制。(A) THF-II识别THF的分子机理及其复合物的高级结构,(B) SAXS分析揭示镁离子和配体结合调控THF-II的构象动态变化,(C) THF-II在翻译水平调控基因表达的模型。
总之,该项工作通过整合多种研究方法(X射线晶体学、小角X射线散射、等温滴定量热以及RNase H切割实验等),深入研究了一类具有简单结构的THF核糖开关的高级结构、构象动态与相互作用,揭示了其特异性识别配体及在翻译水平调控基因表达的分子基础。该项研究成果也可为功能RNA的从头设计、开发基于核糖开关的RNA传感器、靶向RNA的小分子药物设计等研究提供重要参考。
清华大学生命学院副教授方显杨为本文通讯作者。 清华大学生命学院2017级已毕业直博生徐礼磊,博士后肖裕为论文并列第一作者,2020级博士生张杰为本研究做出了重要贡献。清华大学X射线晶体学平台,药学中心活性筛选平台,上海同步辐射光源BL18U1和BL19U1线站,美国阿贡国家实验室12-ID-B线站为本研究提供了设备和技术支持;清华大学生命学院王佳伟教授指导了晶体模型修正。该研究受到国家自然科学基金委、北京市生物结构前沿中心的经费支持。
原文链接:https://doi.org/10.1093/nar/gkac1257