囊泡转运是细胞内物质运输的主要方式,分为出芽、移动、拴系和融合四个步骤。由拴系蛋白介导的拴系是指转运小泡与其受体之间的初始、远距离相互作用,这一步被认为对于建立囊泡靶向转运的特异性是必不可少的。拴系蛋白TRAPP家族蛋白具有鸟嘌呤核苷酸交换功能,可以将Ypt/Rab GTP酶从非激活状态转换成激活状态,进而招募下游的效应因子调控囊泡运输。酵母TRAPPII是酵母TRAPP家族中最大的成员,分子量约为1MDa,调控高尔基体内部和内吞体到晚期高尔基体之间的囊泡运输。人体中TRAPPII的缺陷引起多种疾病。然而由于TRAPPII复合体的复杂性,对于它的研究较为缓慢,尤其是完整TRAPPII的高分辨率结构信息非常匮乏,限制了对其作用机制的认识。
2022年1月26日,清华大学生命科学学院隋森芳教授课题组在Science Advances 上发表了题为“TRAPPII复合物的组装和特异激活GTP酶Ypt31/32的结构基础(Structural basis for assembly of TRAPPII complex and specific activation of GTPase Ypt31/32)” 的研究论文。通过结构生物学、酵母遗传学以及生物化学等手段揭示了TRAPPII复合体的组装方式和作用机制。
隋森芳团队纯化获得了酵母内源完整的TRAPPII复合体,成功重组了TRAPPII-Ypt32蛋白质复合体,并利用冷冻电镜单颗粒分析技术解析了它们的结构,整体分辨率分别为3.87Å和4.46Å。TRAPPII及TRAPPII-Ypt32均呈现为一个由两个三角形单体构成的同源二聚体结构。TRAPPII的单体存在两种构象:闭合构象和开放构象,分辨率分别为3.71Å和4.15Å。二聚体则存在三种状态,两个单体均为闭合构象的状态I,两个单体分别为闭合构象和开放构象的状态II和两个单体均为开放构象的状态III。结构分析表明Tca17与TRAPPI结合方式的不同是TRAPPII单体构象变化的主要原因之一。TRAPPII-Ypt32单体仅呈现一种闭合构象,分辨率为3.86Å。在TRAPPII-Ypt32复合体中,Ypt32位于TRAPPII单体内部,其核苷酸结合结构域与TRAPPI和TRAPPII特有蛋白组分Trs120都有相互作用,同时其高可变区结构域与TRAPPI亚基Trs31相互作用。这些相互作用诱导Ypt32的构象发生变化,促进核苷酸的释放,进而激活Ypt32。基于我们解析的TRAPPII及TRAPPII-Ypt32单体及二聚体冷冻电镜结构,并结合交联质谱、突变分析、酵母遗传学等实验,我们阐明了TRAPPII的组装方式,以及TRAPPII特异激活Ypt32的可能机制。
清华大学生命科学学院隋森芳教授和孙珊副研究员为本文共同通讯作者。清华大学博士生密晨琛,博士后张立、博士生黄国强为本文的共同第一作者。清华大学博士后杨帆参与了电镜数据分析;博士生游鑫参与了原子模型搭建;北京生命科学研究所董梦秋研究员和邵光灿博士生进行了交联质谱的工作。国家蛋白质科学研究(北京)设施清华基地冷冻电镜平台和计算平台,以及清华大学高性能计算平台为数据收集和处理提供了支持。膜生物学国家重点实验室、北京市结构生物学高精尖创新中心、科技部、国家自然科学基金等为本研究提供了经费支持。
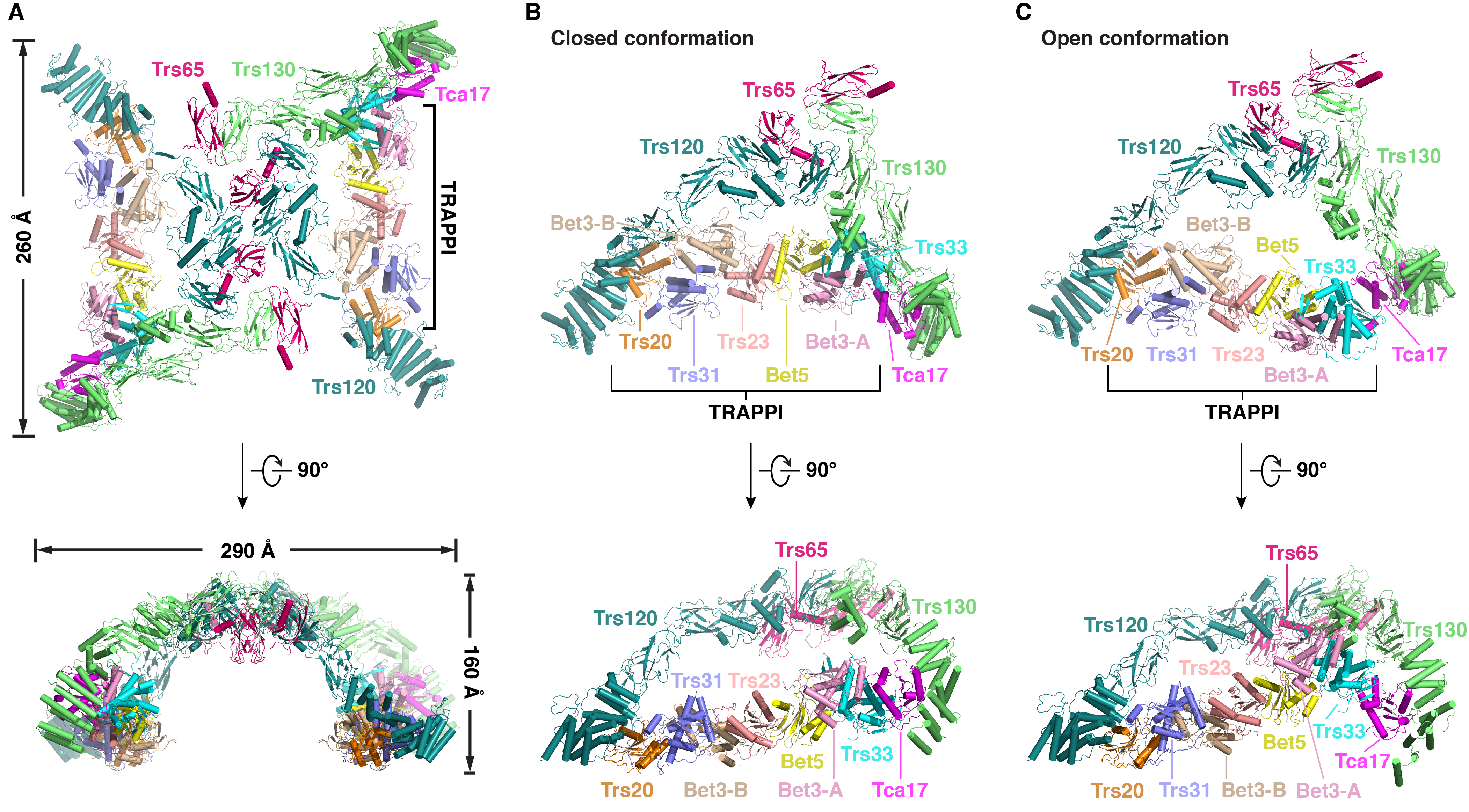
酵母TRAPPII复合体的结构。A,处于状态I的完整TRAPPII复合体的结构。B,闭合构象的TRAPPII单体的结构。C,开放构象的TRAPPII单体的结构。
论文链接:https://www.science.org/doi/10.1126/sciadv.abi5603