
囊膜病毒门类众多,其中不乏臭名昭著之辈,例如埃博拉病毒(Ebola),艾滋病病毒(HIV),流感病毒(influenza),以及新冠病毒等(SARS-CoV-2 virus)。研究其结构、入侵机制以及生命周期是针对性开发疫苗、抗体以及药物的基础,一直是结构生物学热点。但囊膜病毒的多态性给传统结构生物学手段带来不少麻烦,其较小的尺寸(直径~100nm)也给在细胞内直接观察这些病毒的生命活动带来了挑战(图1)。回顾过去20年来,cryo-ET技术与结构病毒学协同发展,相互促进:为在动态组装、多形的囊膜病毒上直接解析高分辨蛋白结构,分子cryo-ET方向向高通量、高分辨方向发展;为一窥病毒在细胞中的生命活动,细胞cryo-ET方向新型特异性生物标记、冷冻光电联合成像(cryo-CLEM)、冷冻聚焦离子束减薄(cryo-FIB milling)等方向发展。2020年,cryo-ET为全面展示新冠病毒完整结构、组装规律、病变细胞结构等方面做出了卓越的贡献,已在顶尖刊物发表多篇文章,其中包括2020年9月李赛实验室解析的完整新冠病毒三维结构。这些工作不仅为病毒学、疫苗、抗体研究提供了高分辨结构信息,也为科普、防疫等带来大量真实准确的影像材料。
2021年9月10日,清华大学生命科学学院李赛副教授应邀在国际知名学术期刊Trends in Biochemical Sciences的冷冻电镜特刊发表题为《囊膜病毒研究中的冷冻电镜断层成像技术》(Cryo-electron tomography of enveloped viruses)的综述文章,系统总结了cryo-ET在解析囊膜病毒结构,揭示其组装和生命周期机制等研究中的应用。文章也系统总结了近年来cryo-ET技术在各方面的提升及应用范围的扩展,并对领域未来进行了展望。
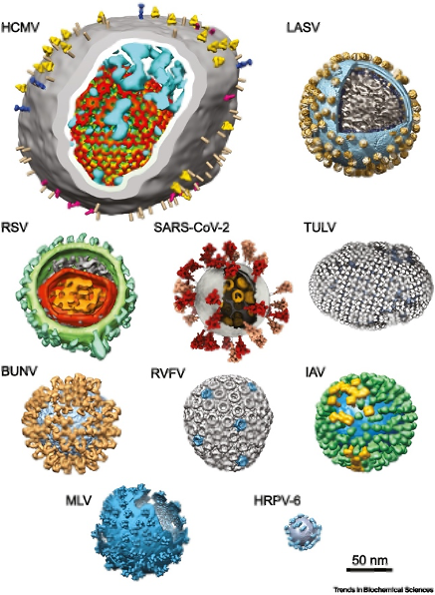
图1:通过cryo-ET和STA解析的多种囊膜病毒结构(左);及通过cryo-EM和单颗粒解析的多种无囊膜病毒结构(右, T.Baker et al. 1999)
蓬勃发展的cryo-ET技术及原位结构生物学
原位结构生物学的目标是将超大蛋白质机器从生物膜、病毒、细胞、甚至组织环境中直接解析,以获得其在体结构、与核酸/生物膜的互作关系及分布信息。原位结构生物学核心技术是cryo-ET:它是将置于透射电镜样品台上的冷冻样品沿固定轴旋转,并从多个角度拍照获得倾转系列(tilt series, TS),将其重构为三维断层图像,再使用子断层平均法(sub-tomogram averaging, STA)进行结构解析的新型结构生物学方法。过去10年,为解决不同尺度的结构生物学问题,cryo-ET领域也开发出一系列样品制备、蛋白定位、数据分析等配套技术,它们包括:快速投入式冷冻制样、高压冷冻制样、冷冻光电联合成像(cryo-CLEM)、电镜可见的特异性生物标记、冷冻聚焦离子束减薄(cryo-FIB milling)、相位板(VPP)、基于人工智能的图像识别、降噪和图形分割等。现今,cryo-ET不再仅指采集倾转系列数据的方法,而成为一种包纳上述多种前沿技术的独立的结构生物学方向。
相比传统的冷冻电镜方法,cryo-ET的原始数据增加了精确的Z轴信息,因此对样品纯度及组装严格性要求较低,且在制备样品过程中无需使其脱离原生环境,获得的结构更具生理意义。随着它的日益完善,从病毒到细菌、细胞甚至组织维度间的结构生物学空白将得到填补(图2)。
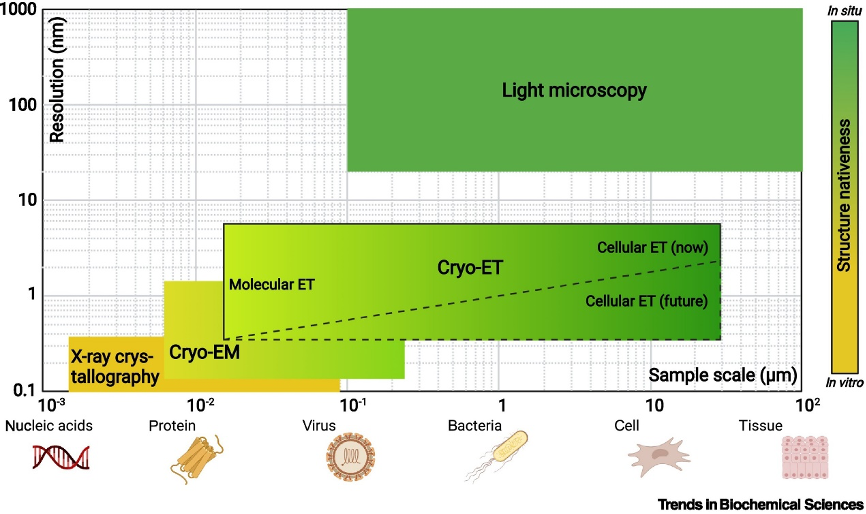
图2:结构生物学以及显微技术的对比
Cryo-ET解析蛋白质复合物高分辨结构需要收集含有数万个目标复合物的照片,因此,在细胞等原位环境中高效的寻找目标复合物是原位结构生物学的前提。然而,蛋白质复合物、病毒与细胞、组织之间存在巨大的尺寸差异,而且细胞内部环境极为拥挤、嘈杂,这给寻找目标复合物带来了巨大挑战。举例说明,由于尺寸比例近似,在细胞中找到一颗病毒的难度好比在黄昏时满是人群的足球场找到一颗足球。因此,仅使用冷冻电镜在细胞中“碰运气”式的寻找目标复合物将极为低效。目前有多种方案解决这个问题,目标均是在细胞中实现单分子的定位精度,它们可分为两类:1)新型特异性生物标记;2)CLEM将光学显微镜与电镜关联。
Cryo-ET是揭示囊膜病毒结构、膜融合过程的利器
李赛在综述中系统阐述了cryo-ET和STA如何作为囊膜病毒研究的有力工具。Cryo-ET技术不仅能重构病毒的完整结构组装(图1),还可提供组成病毒的各类结构蛋白的原位高分辨结构,如糖蛋白、基质蛋白等。其中病毒表面糖蛋白是病毒入侵细胞的关键分子、免疫防御的重要靶标,因而在结构蛋白研究中最受关注。Cryo-ET技术则提供了有关糖蛋白的多维度原位结构信息。例如,cryo-ET发现新冠病毒表面刺突蛋白可在病毒表面以一个较大的角度进行摆动;又如,丙型流感病毒表面糖蛋白HEF会在原位形成六聚的高聚结构,使得在原位上,HEF蛋白的头部比晶体结构中有更多的旋转和扩大(图3)。这些原位结构的解析为疫苗、抗体的研发提供了病毒在天然状态下的更多细节。
同时,文章翔实归纳了cryo-ET技术是如何贡献于体外模拟膜融合、及融合过程中糖蛋白构象变化的相关研究。例如,传统的结构研究方法限制了糖蛋白不能处于原位的膜环境、从而降低了解析膜融合过程的可靠性,而cryo-ET技术恰好弥补了这一缺憾。李赛曾利用酸化孵育条件诱导裂谷热病毒糖蛋白发生构象变化、介导与脂质体发生膜融合,并运用cryo-ET技术成功在孵育30秒的时间点捕捉并解析了裂谷热病毒糖蛋白变构插入脂质体的中间结构。由此可以窥见cryo-ET技术使得更多复杂体外条件的结构解析变为可能,展现了宽广的应用场景。
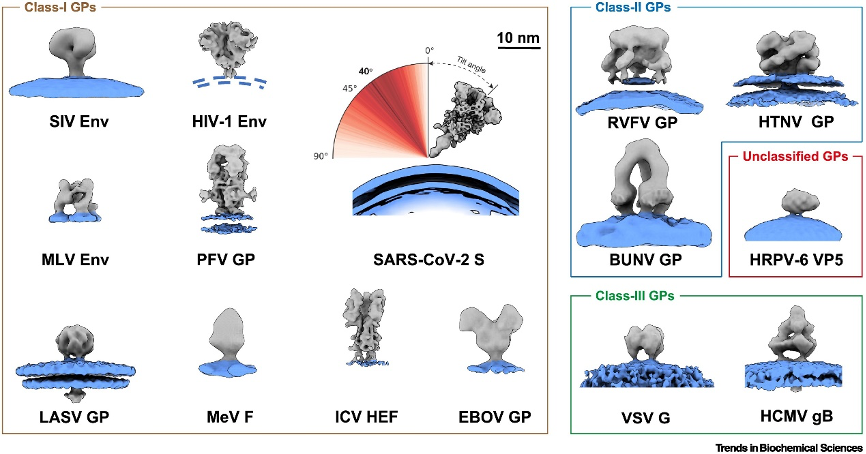
图3:通过cryo-ET和STA解析的多种囊膜病毒刺突蛋白原位结构
Cryo-ET将病毒在病变细胞中的生命活动从通路图变成真实结构
研究病毒的生命周期:入侵,释放基因组,复制,组装,释放等一直以来是病毒学研究的重点和难点,也为抗病毒靶点的筛选与抗病毒机制的研究提供了依据。李赛研究员在综述中系统阐述了cryo-ET在观察病毒生命周期中的应用成果。例如利用cryo-ET研究正义链RNA病毒发现,这些病毒大多数在感染细胞后会改变细胞的膜系统,从而在胞内形成一类被称为“病毒工厂”的囊泡结构来进行病毒核酸的复制。
展望
综述不仅对囊膜病毒的结构研究进行了细致的梳理,也归纳了目前分子、细胞cryo-ET技术在制样、标记、数据采集和处理上层出不穷的新技术。随着这些技术的开发,cryo-ET技术在未来具有更加广阔的应用前景。然而,不少技术目前仍在探索阶段,还有太多空间可以拓展。作为一门年轻的技术,cryo-ET在每年发表的电镜结构里仅做出不到20%的贡献:主要是由于其采样费时,图像处理方法不完善等原因所导致的低分辨率(~20-40Å),这也成为该领域亟待解决的难题。李赛及其团队在过去的九年里一直致力于提高cryo-ET技术的分辨率和易用性,力图解决目前cryo-ET结构解析过程中的低效、手动、长学习曲线、低分辨等难点,并积极在国内外推广cryo-ET技术(图4)。
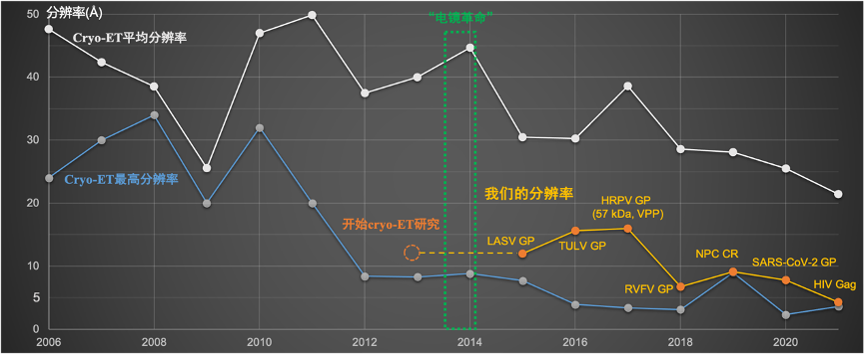
图4:李赛及其团队在cryo-ET和STA技术上的科研历程
清华大学生命学院、结构生物学高精尖创新中心、清华-北大生命科学联合中心、清华大学未来疫苗中心李赛副教授是本综述作者,该研究受到清华大学春风基金、英伟达公司的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0968000421001857
作者简介
李赛,副教授,博士生导师。2006年毕业于武汉大学;2012年获得德国哥廷根大学理学博士学位;2012-2018年,在英国牛津大学任博士后、副研究员;2018年在清华大学建立实验室。实验室网址:www.lisailab.com

过去9年,李赛以高分辨冷冻电镜断层成像为主要研究方法,开展了多种动态组装超大分子机器结构与组装机制的研究。共发表论文26篇,通讯和第一作者论文10篇。主要工作包括:1)发展了高通量、高分辨率cryo-ET技术,目前可常规性获得好于9Å分辨率;2)利用该方法,系统研究了多种致病型囊膜病毒的原位结构及组装,代表性工作为新型冠状病毒的完整病毒分子结构,发表在《细胞》。在拉沙、裂谷热、汉塔、流感病毒等方面的成果发表在《自然·通讯》、《细胞报告》、《公共科学图书馆·病原体》等刊物;3)使用cryo-ET将核孔复合物的原位结构局部分辨率推进至9Å,并发现腔环新结构,发表在《细胞研究》。以上成果多次获得F1000推荐或成为ESI高引用论文,入选教育部“2020年中国高等学校十大科技进展”、浙江省“2020年科技进步一等奖”等。曾获得“中国电镜学会优秀青年学者”等奖励,受邀在2021年GRC 3DEM国际冷冻电镜大会做开幕特邀报告。